我院马爱进教授作为共同通讯作者在《自然-通讯》发表重要论文
时间:2023-12-14 来源:皇冠正规娱乐平台 作者:
2023年12月9日,《自然-通讯》(Nature Communications)杂志在线发表了我院马爱进教授与中国农业大学生物学院韩建永教授和西北农林科技大学食品学院冯宪超教授的研究成果《稳定的猪上胚层干细胞制备三维肉样组织》(Generation of three-dimensional meat-like tissue from stable pig epiblast stem cells)。

动物细胞培养肉的制备是未来食品业的一项颠覆性技术, 有望作为传统畜牧业的有效补充, 从而有利于促进环境可持续性和农业碳减排,保障公共卫生安全和动物福利,缓解人畜口粮竞争。全球已有超过上百家研究机构或初创公司进行细胞培养肉的研发, 但实现细胞培养肉的规模化生产仍面临诸多挑战, 其中优质种子细胞的获取、无动物源成分的培养基和3D可食用支架的研发、大规模培养的工程化等是细胞培养肉产业化过程中亟需解决的技术瓶颈。
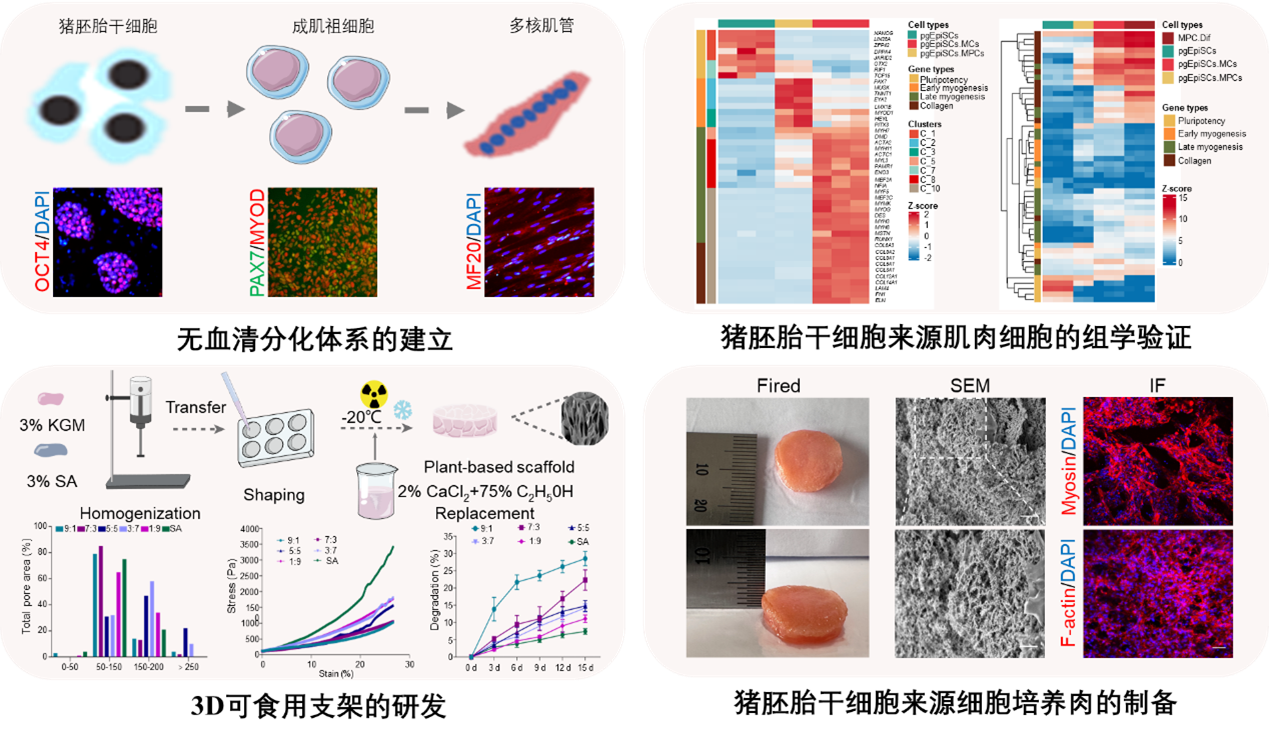
该研究建立了猪胚胎多能干细胞向肌肉无血清定向诱导分化的技术体系, 并结合无动物源成分的3D支架, 首次实现了猪胚胎多能干细胞来源动物细胞培养肉的制备。具备以下创新性:
1.攻克了干细胞体外长期稳定传代问题
胚胎干细胞具有体外无限扩增及分化成各种组织细胞的能力, 是细胞培养肉的理想种子细胞。研究团队独辟蹊径、突破瓶颈, 创建了猪稳定胚胎干细胞分离培养技术体系 (Cell Research, 2021) , 解决了近40年来大家畜胚胎干细胞建系的国际难题。本研究进一步验证该细胞系可体外长期稳定传代并维持细胞的多能性及基因组的稳定(截至发文已传超过300代),而细胞培养肉领域常用的肌肉干细胞只能传代20-30代。如果按胚胎干细胞最低增殖比例1:3进行传代, 一个起始细胞在约30代的时候可获得330个细胞,即可生产出相当于一头成年猪的所有细胞量(约1014个细胞),只需要50代即可生产出相当于70亿头生猪的细胞量,为中国生猪年出栏量的10倍,而且只需要100-150天。因此具有自主知识产权的猪胚胎干细胞分离培养技术体系不仅解决了大家畜干细胞建系的国际难题,也有望成为细胞培养肉产业领域的重要底盘技术, 为抢占该领域创新和产业发展的制高点提供技术与资源保障。
2. 建立了猪胚胎干细胞向肌肉细胞无血清定向诱导分化的技术体系
本研究建立了猪胚胎干细胞向肌肉细胞分阶段定向诱导分化的技术体系, 可实现全程无血清添加和无转基因的肌原性分化,并研发出适合猪胚胎干细胞肌原性分化的无血清培养基。组学层面进一步验证所获得的肌肉细胞与体内的肌肉细胞相似,可确保细胞培养肉的清洁与安全, 有望实现细胞培养肉营养可控等多种要求。
3. 研发了无任何动物源成分的3D可食用支架
本研究解决了干细胞分化过程中与可食用3D支架的亲和性问题, 研发了无任何动物源成分的3D可食用支架, 实现了细胞体外大量扩增。本研究还首次成功利用猪胚胎干细胞分化技术制备了与正常肉类指标相似的细胞培养肉, 具有明显的肌肉外观和纹理,而且富含条件必需氨基酸,不易受食源性致病菌的污染,表明本研究已具备了迈向产业化的理论与技术。
因此,该研究不仅有望解决起始细胞长期稳定扩增的问题, 提高胚胎来源的多能干细胞在动物细胞培养肉研发中的利用率, 还能为其它家畜动物细胞培养肉的制备提供理论参考, 也有望为未来功能性食品的研发和“清洁”肉类的供应提供新的技术途径和科技支撑。
中国农业大学的朱高翔博士(已毕业)、高登峰博士(已毕业)和西北农林科技大学李鳞子博士 (在读) 为本文的共同第一作者。我院马爱进教授与中国农业大学生物学院韩建永教授和西北农林科技大学食品学院冯宪超教授为本文的共同通讯作者。
原文链接:https://doi.org/10.1038/s41467-023-44001-8。